![]() НУЖНЫ ЕЩЕ РЕФЕРАТЫ? ЖМИ СЮДА!!!
НУЖНЫ ЕЩЕ РЕФЕРАТЫ? ЖМИ СЮДА!!!![]()
Боль. Антиноцицептивная система.
Боль, как
реакция на повреждающие (ноцицептивные) воздействия представляет собой
важнейший биологический феномен, непосредственно обеспечивающий выживание
организма в экстремальных условиях. Боль рассматривают как ключевой фактор
эволюционного развития животного мира (Houdart, 1993). Это представление о боли
нашло отражение в большинстве ее существующих определений.
П.К. Анохин определял боль как "реакцию,
мобилизующую разнообразные функциональные системы для защиты организма от
воздействия вредящего фактора и включающую сознание, память, мотивации и
эмоции". Определение, рекомендуемое Международной Ассоциацией
Исследования Боли, трактующее ее как "неприятное сенсорное и
эмоциональное ощущение, связанное с действительным или потенциальным
повреждением ткани, или описываемое в терминах такого повреждения".
При этом подчеркивается, что боль всегда субъективна, зависит от
предшествующего жизненного опыта и множества индивидуальных особенностей.
Болевые ощущения присущи уже простейшим
животным и даже по некоторым данным растениям. В настоящее время установлено,
что человек способен ощущать боль уже во время внутриутробного этапа развития.
Так в Амстердаме были представлены новые сведения, указывающие на то, что к 30й
неделе плод способен реагировать сокращениями мимической мускулатуры в ответ на
болевые раздражители. То, что новорожденные испытывают боль, уже практически не
подлежит оспариванию.
Боль для пациентов - один из
важнейших клинических признаков любого патологического процесса и одно из самых
отрицательных проявлений болезни. В то же время своевременная и правильная
оценка болевого синдрома помогает врачу составить представление о характере
заболевания.
В понятие боли включаются,
во-первых, своеобразное ощущение боли и, во-вторых, реакция на это ощущение,
характеризующаяся определенной эмоциональной окраской, рефлекторными
изменениями функций внутренних органов, двигательными безусловными рефлексами и
волевыми усилиями, направленными на устранение болевого воздействия.
Реакция на боль чрезвычайно
индивидуальна, так как зависит от влияния факторов, из которых основное
значение имеют локализация, степень повреждения тканей, конституциональные
особенности нервной системы, воспитание, эмоциональное состояние пациента в
момент нанесения болевого раздражения.
Из всех видов чувствительности боль
занимает особое место. В то время как другие виды чувствительности в качестве
адекватного раздражителя имеют определенный физический фактор (тепловой,
тактильный, электрический и пр.), боль сигнализирует о таких состояниях
органов, которые требуют специальных сложных приспособительных реакций. Для
боли нет единого универсального раздражителя. Как общее выражение в сознании
человека боль вызывается разнообразными факторами в различных органах.
Соотношение понятий "боль"
и "ноцицепция"
Термин ноцицепция происходит от латинских Nocere - вредить и Cepcio -
воспринимать и означает процесс восприятия повреждения. Активация ноцицепторов
и ноцицептивных путей не всегда сопровождается болью, поэтому следует различать
термины боль и ноцицепция. Боль, как субъективное ощущение, возникает на
корковом уровне, а процессы, происходящие на всех нижележащих уровнях нервной
системы относятся к ноцицепции. Ноцицептивная система представлена нервными
структурами, их элементами и биохимическими механизмами восприятия повреждающих
воздействий и подробно описана. В отличие от ноцицепции боль представляет собой
более сложное ощущение, в котором ноцицепция соединяется с субъективным опытом,
включающим сильный эмоциональный (аффективный) компонент.
Общие механизмы болевой (ноцицептивной) чувствительности.
Афферентные (приносящие)
ноцицептивные периферические нервы содержат первичные волокна малого диаметра,
имеющие рецепторы в различных органах и тканях. Ощущение боли сопряжено с
появлением электрической активности - деполяризацией чувствительных нервных
окончаний.
Для чувствительных окончаний
возбуждающими могут явиться разнообразные механические, термические, химические
стимулы.
Согласно одной гипотезе, боль не является
специфическим чувством, и не существует специальных рецепторов, воспринимающих
только болевое раздражение. Любое раздражение тех или иных рецепторов может
вызвать чувство боли, если сила раздражения достаточно велика.
Согласно другой, более распространенной
точке зрения, существуют специальные болевые рецепторы, характеризующиеся
высоким порогом восприятия - возбуждающиеся стимулами "повреждающей"
интенсивности.
В то время как проводниками
тактильной и глубокой чувствительности служат толстые миелинизированные волокна
с высокой скоростью распространения импульса (Аa, Аb), проведение
периферического болевого раздражения обеспечивается медленно проводящими
нервными волокнами малого диаметра, значительно более устойчивыми к условиям
аноксии.
Существуют афферентные ноцицептивные
волокна двух типов:
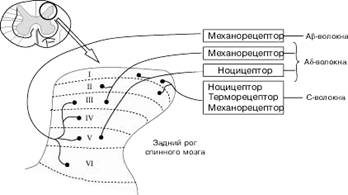 Аксоны афферентных ноцицептивных
волокон заканчиваются в столбах заднего рога спинного мозга (рис.1).
Аксоны афферентных ноцицептивных
волокон заканчиваются в столбах заднего рога спинного мозга (рис.1).
Рис. 1. Локализация окончаний чувствительных волокон в столбах заднего рога
спинного мозга. Аксоны афферентных чувствительных нервных волокон заканчиваются
в соответствующих сегментах заднего рога спинного мозга. Здесь они контактируют
с передаточными нейронами спиноталамического пути. Аb-волокна, ответственные за
тактильную чувствительность, проецируются в III-VI сегментах. Аd-волокна,
ответственные за тактильную чувствительность и ноцицепцию, проецируются в I-III
и V сегментах. С-волокна, проводящие болевые, температурные и тактильные
стимулы, проецируются в I и II сегментах
Здесь они контактируют с
передаточными нейронами спиноталамического пути, по которому болевая имульсация
достигает задних ядер таламуса (рис. 2), а затем соматосенсорного поля коры
большого мозга.
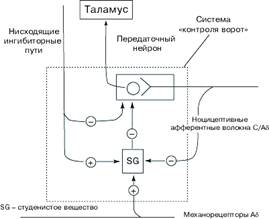 Клетки II сегмента заднего рога
составляют студенистое вещество (substantia gelatinosa - SG). Согласно теории
"контроля ворот" (Wall, Melzack. Gate control theory. - 1965),
короткие вставочные нейроны, составляющие SG, регулируют проведение болевых
импульсов от периферических афферентных волокон к зрительномубугру(рис.2).
Клетки II сегмента заднего рога
составляют студенистое вещество (substantia gelatinosa - SG). Согласно теории
"контроля ворот" (Wall, Melzack. Gate control theory. - 1965),
короткие вставочные нейроны, составляющие SG, регулируют проведение болевых
импульсов от периферических афферентных волокон к зрительномубугру(рис.2).
Рис. 2. Система "контроля ворот". Аксоны афферентных ноцицептивных
волокон контактируют с передаточными нейронами спиноталамического пути, по
которому болевая имульсация достигает задних ядер таламуса, а затем
соматосенсорного поля коры большого мозга. Нервные клетки SG подавляют передачу
нервного импульса от афферентных ноцицептивных волокон и нейронами
спиноталамического тракта. SG-интернейроны активируются нисходящими
ингибиторными нейронами и волокнами неноцицептивной чувствительности;
тормозятся афферентными ноцицептивными С-волокнами
Нервные клетки SG проецируются на
сегменты I и V заднего рога. Посредством пресинаптического торможения они
ингибируют передачу нервного импульса на уровне первого синапса между
афферентными ноцицептивными волокнами и передаточными нейронами
спиноталамического тракта.
Активность самих SG-интернейронов
подвержена модулирующим влияниям.
Они активируются нисходящими
ингибиторными нейронами или неноцицептивными афферентными импульсами (например,
импульсами тактильной чувствительности, проводящимся по Аb-волокнам).
Таким образом, нервные импульсы,
приходящие по толстым волокнам, "закрывают ворота" для потока болевой
импульсации. "Отвлекающие процедуры", усиливающие импульсацию в
толстых миелиновых волокнах, способствуют уменьшению чувства боли. При
повреждении толстых волокон (например, в условиях гипоксии, при механическом
повреждении) болевая чувствительность усиливается.
SG-интернейроны тормозятся
афферентными ноцицептивными С-волокнами. Благодаря постоянной электрической
активности ноцицептивных С-волокон облегчается возбуждение передаточных
нейронов спиноталамического тракта под воздействием импульсов как болевой, так
и неболевой чувствительности.
SG-интернейроны богаты опиоидными
пептидами и опиоидными рецепторами.
Аналогичная система "контроля
ворот" существует и в таламусе.
Результаты многочисленных наблюдений
и исследований позволили сформировать представление о существовании в организме
антиноцицептивной системы, подавляющей восприятие боли. Структуры, относящиеся
к этой системе, включают некоторые зоны центрального серого вещества, покрышки
моста, миндалевидного тела, гиппокампа, ядер мозжечка, сетчатой формации. Они
оказывают нисходящий, цереброспинальный, контроль афферентного
"притока", вызывая торможение нейронов спинного мозга.
Гуморальные механизмы регуляции
ноцицептивной чувствительности
Можно заключить, что ноцицептивные
нервные окончания являются хемочувствительными, поскольку воздействие всех
раздражителей, вызывающих ощущение боли (механические, термические,
воспалительные, ишемические, химические), связано с изменением химического
окружения болевых рецепторов.
На рис. 3 представлено многообразие
факторов, с помощью которых осуществляется нейрогуморальная регуляция болевой
чувствительности на разных уровнях.
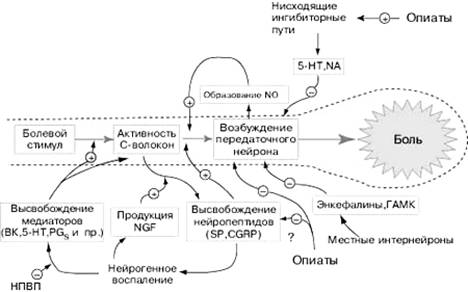
Рис. 3. Механизмы регуляции ноцицептивного пути. Болевой стимул воспринимается
ноцицептивными афферентными волокнами, передающими возбуждение передаточным
нейронам спиноталамического тракта. Далее по таламокортикальным волокнам
импульс достигает коры головного мозга, где формируется восприятие боли.
Передача болевого импульса с периферии на передаточные нейроны
спиноталамического тракта облегчается посредством NO, SP и CGRP. Медиаторами
нисходящих цереброспинальных антиноцицептивных импульсов служат 5-HT, NA.
Медиаторами антиноцицептивных импульсов от SG-нейронов - энкефалины, ГАМК.
При нейрогенном воспалении наблюдается избыточное и длительное высвобождение
нейропептидов SP, CGRP из С-волокон, поддерживаемое такими воспалительными
веществами, как BK, 5-HT, PGs и NGF. Применение НПВП позволяет уменьшить
продукцию воспалительных медиаторов. Опиаты снижают болевую чувствительность посредством
активации нисходящих антиноцицептивных сигналов и угнетения передаточных
нейронов спиноталамического тракта. NGF - фактор роста нервов, BK - брадикинин,
5-НТ - 5-гидрокситриптамин (серотонин), PGs - простагландины, NA -
норадреналин, SP - субстанция Р, CGRP - пептид, относящийся к гену кальцитонина
Рассмотрим химические медиаторы,
участвующие в ноцицептивной передаче и регуляции потока болевых импульсов.
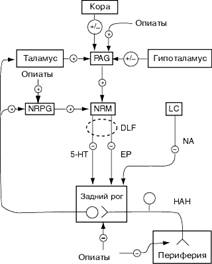 Рис. 5. Нисходящая система контроля
- главные зоны участия опиатов-в-передаче-боли.
Рис. 5. Нисходящая система контроля
- главные зоны участия опиатов-в-передаче-боли.
Опиоиды снижают чувствительность болевых рецепторов, угнетают синаптическую
передачу болевого импульса на уровне заднего рога спинного мозга. Под их
воздействием активируется антиноцицептивный цереброспинальный контроль:
возрастает поток активирующих импульсов из парагигантоклеточного ретикулярного
ядра и периакведуктального серого вещества к большому ядру шва, нейроны
которого тормозят передачу ноцицептивного сигнала на уровне задних рогов
спинного мозга. PAG - периакведуктальное серое вещество, NRPG -
парагигантоклеточное ретикулярное ядро, NRM - большое ядро шва, LC - locus
ceruleus, DLF - дорсолатеральный канатик, 5-HT - 5-гидрокситриптамин
(серотонин), EP - энкефалин, NA - норадреналин, HAH - ноцицептивный афферентный
нейрон (по Fields, Basbaum, 1994)
Кроме того, под их воздействием возрастает поток активирующих импульсов из
парагигантоклеточного ретикулярного ядра и периакведуктального серого вещества
к большому ядру шва, нейроны которого тормозят передачу ноцицептивного сигнала
на уровне задних рогов спинного мозга.
Современная нейропатологическая
концепция (Крыжановский, 1997) в качестве обязательного компонента развития
болевых синдромов рассматривает ослабление тормозного контроля со стороны
антиноцицептивной системы. Элементы антиноцицептивной системы распределены на
всех уровнях проведения болевой информации, она включает определенные структуры
и механизмы, деятельность которых направлена на подавление боли. Постоянное
взаимодействие ноцицептивной и антиноцицептивной систем осуществляют функцию
контроля боли. Активация ноцицептивной системы в норме вызывает и повышение
активности антиноцицептивных механизмов. Взаимодействие механизмов ноцицепции и
антиноцицепции происходит уже на уровне периферических афферентных
ноцицептивных волокон. Психоэмоциональные компоненты боли, традиционно
рассматривавшиеся как результат взаимодействия нейрохимических механизмов
коркового и подкоркового уровней организации системы контроля боли, в
значительной мере предопределяются от периферическими механизмами.
Ослабление тормозного контроля со
стороны антиноцицептивной системы провоцирует образование ансамблей
взаимодействующих гиперактивных ноцицептивных нейронов, по определению Г.Н.
Крыжановского - генераторов
патологически усиленного возбуждения (ГПУВ). Первичные ГПУВ в соответствии
с характером повреждающего воздействия и собственными морфо-функциональными
особенностями индуцируют появление вторичных генераторов, существенно
изменяющих нормальную структуру системы болевой чувствительности. Новая
патодинамическая структура системы контроля боли составляет патологическую
алгическую систему. Патологическая алгическияя система в зависимости от своих
конкретных характеристик определяет клиническую картину болевого синдрома. В
отличие от адаптогенного характера физиологической, патологическая боль
оказывает дезадаптирующее влияние на организм.
Разновидности боли
Согласно современным представлениям
различают физиологическую и патологическую боль, выделяют три основных типа
боли: соматогенную, нейрогенную и психогенную. Нет четких границ между
собственно соматогенной и висцеральной болью, психогенной и идиопатической
болью. Существующая классификация боли далека от совершенства и границы между
отдельными типами и классами болевых синдромов весьма условны.
Боль также
классифицируют:
Острая боль - интенсивное неприятное ощущение,
обусловленное чрезмерной повреждающей стимуляцией чувствительных рецепторов.
Хроническая боль - результат дисфункции нормального
ноцицептивного канала, в частности нарушения работы SG.
Существуют разновидности хронической
боли:
В возникновении гипералгезии и
аллодинии играет роль нарушение баланса нейрогуморальных воздействий:
В условиях воспаления повышается
выработка SР нервными клетками. Воздействуя на кровеносные сосуды и клетки
иммунной системы (макрофаги), SР, CGRP и другие провоспалительные субстанции
способствуют развитию так называемого нейрогенного воспаления.
При нейрогенном воспалении
поддерживается повышенная активность нейрогенных афферентных волокон (в этом
важная роль принадлежит NK1-рецепторам нейронов) и формируется гипералгезия.
Отдельно следует охарактеризовать
такой вид хронической боли, как нейропатическая
- тяжелая боль нейрогенного происхождения. Причина ее возникновения -
непосредственное поражение сенсорного пути, обычно с вовлечением периферических
механизмов формирования боли.
В качестве примеров болезней,
сопровождающихся нейропатической болью, можно привести инфаркт миокарда,
множественный (системный) склероз, поражение нервов (механическая травма,
спондилоартрит, диабетическая нейропатия, злокачественная опухоль, herpes
zoster и др.).
Ампутационная (фантомная) боль также
представляет собой вариант нейропатической боли.
Непосредственными механизмами
формирования болевого ощущения при нейропатической боли могут быть:
Нейропатическая боль плохо
контролируется обычными анальгетиками.
Оценка боли
Объективная оценка боли является главной методологической проблемой алгологии, ибо трудно,
если вообще возможно, измерить субъективное ощущение, каковым по определению
является боль. В связи с этим предпринимались многочисленные попытки оценивать
боль по различным ее коррелятам в виде спонтанной и вызванной биоэлектрической
активности мозга и мышц, гемодинамическим, термографическим биохимическим и
иным показателям. Однако ни один из них не является достаточно специфичным,
коэффициенты корреляции между ними и субъективными болевыми ощущениями как
правило оказываются не достоверными.
В клинической практике для оценки
боли используют различные варианты интервью,
наиболее известным из которых является Мак-Гилловский болевой опросник.
Выбранные пациентом сенсорные, интенсивностные и аффективные характеристики
актуальной боли определенным образом ранжируются и представляются в цифровом
выражении. Методы оценки собственно боли дополняются тестами качества жизни,
позволяющими определить выраженность дезадаптации пациента. Простейшим и самым
распросраненным алгометрическим методом является визуально-аналоговая шкала, на
которой пациент фиксирует положение, соответствующее интенсивности его
актуального болевого ощущения в диапазоне от полного отсутствия боли до
максимального воображаемого уровня ее выраженности.
На основании самооценок различных
компонентов боли, факторов провоцирующих ее возникновение и влияния на качество
жизни с использованием принципа визуально-аналоговой шкалы строится
индивидуальный "профиль боли" (рис. 1). По длине радиальных отрезков
профиля проводят дифференциальную оценку различных компонентов боли, а по
площади всего профиля - ее интегральную оценку. В зависимости от конкретной
ситуации можно менять количество и вид шкал профиля, например вводить шкалы
характеризующие выраженность вегетативных, психических или иных индивидуальных
проявлений боли. Метод удобен для мониторинга боли служит целям вспомогательной
дифференциальной диагностики, оценки эффективности использования тех или иных
методов обезболивания. Построение пациентами собственных болевых профилей
способствует обучению их самостоятельному контролю боли, обычно оказывает
психотерапевтический эффект.
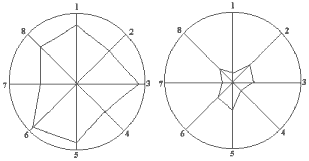
Рис.1. Рисунок 1. Алгограмма- "профиль боли". А - до лечения, Б -
после лечения.
1. Сила (интенсивность) болевых ощущений. 2. Длительность болевых приступов. 3.
Частота возникновения боли. 4. Локализация (кол-во и\или площадь зон тела, где
ощущается боль). 5. Сенсорная характеристика (кол-во выбранных дескрипторов
модальности боли) 6. Влияние провоцирующих факторов (физических, психических,
прочих). 7. Аффективный компонент боли (депрессия, тревожность, прочие
проявления). 8. Социальная дезадаптация (ограничение трудовой, бытовой, прочих
видов активности).
Информативным, но не вошедшим пока в
повседневную клиническую практику, является измерение болевой чувствительности. Порог боли определяется как "минимальное болевое ощущение,
которое субъект может распознать". В психофизике за порог боли принимают
минимальную мощность стимула, который в 50% предъявлений вызывает боль. Уровень (порог) переносимости боли
(pain tolerance level) определяют как наибольшую силу боли, которую субъект
готов переносить в данных конкретных условиях тестирования. Перспективным
направлением алгометрии является регистрация ноцицептивных флексорных рефлексов
и экстероцептивной супрессии произвольной мышечной активности (Данилов, Вейн,
1997).
Пороги боли определяют при
предъявлении стимулов различной модальности - механических, термических,
электрических, ультразвуковых и других, которые определяют название метода.
Чаще всего используется тензоалгометрия, термоалгометрия, электроалгометрия и
ультразвуковая алгометрия. Каждый из используемых методов имеет свои
достоинства и недостатки. В зависимости от используемой модальности в
формировании болевых ощущений, принимают участие различные типы нервных
рецепторов и нейромедиаторов. Поэтому результаты исследования болевой
чувствительности разными методами не совпадают. Кроме того различия в порогах
боли обусловлены особенностями актуального патологического процесса. Например,
в зоне первичной гипералгезии, возникающей непосредственно в месте повреждения,
происходит снижение порога боли как на термическую, так и механическую
стимуляцию. Окружающие ткани - зона вторичной гипералгезии характеризуются
снижением порога боли только на механические воздействия (Treed, Magerl, 1995).
Болевая чувствительность
представляет собой важнейший параметр, определяющий основные свойства личности
и психосоматические отношения человека, служит информативным показателем адекватности
и эффективности его биологической и социальной адаптации, состояния здоровья и
болезни. Установлены связи между болевой чувствительностью и иммунным ответом,
предрасположенностью к развитию нейропатической боли, структурой
неврологических нарушений, вызванных локальной деструкцией спинного мозга,
развитием артериальной гипертензии. Алгометрическое обследование лиц,
предпринимавших суицидальные попытки, показало, что у них повышен уровень
переносимости боли. Болевая чувствительность тесно связана с индивидуальными
психологическими особенностями, с доминирующей на момент обследования
мотивацией и установкой пациентов. Стенические эмоции, связанные с агрессивной
мотивацией сопровождаются повышением порога боли. Астенические эмоции (страх,
беззащитность), сопровождающие стратегию пассивной адаптации и прекращение
текущей деятельности развиваются на фоне снижения порога боли. Мотивации,
эмоции и обстановочная афферентация, связанные с болевой чувствительностью
имеют важное значение для выбора адекватной терапевтической тактики при
различных болевых синдромах.
Лечение боли.
Обезболивающие средства, применяемые
в клинической практике, на разных уровнях воздействуют на ноцицептивный канал.
Выделяют анальгетики следующих классов:
А: Наркотические анальгетики.
Б: Ненаркотические
анальгетики:
В: Противоболевой активностью обладают также центрально действующие неопиоидные препараты:
Г: Локальные анестетики, блокирующие периферические рецепторы
(лидокаин и пр.).
Один из перспективных путей борьбы с
болью - разработка способов активации функции антиноцицептивной системы.
Альтернатива таблеткам:
1.
Акупунктура:
стимулирует распространение эндорфинов, гормонов хорошего самочувствия, но с
большинством разновидностей хронической боли они могут и не справиться.
2.
Чрезкожная
злектростимуляция нерва: электроды, подсоединенные к коже, посылают слабый ток
к пораженному нерву и эффективно заглушают боль.
3.
Каннабис:
активный ингредиент гашиша - весьма перспективное лекарство от боли; известно,
что каннабис помогает больным артритом и рассеянным склерозом. В аптеках
спрашивать пока рано.
4.
Гипноз:
полезен, если ты не можешь расслабиться или боишься больниц.
5.
Анализирующие
помпы: мини-насосы, вживленные под кожу и постоянно выделяющие болеутоляющие
препараты.
6.
Рефлексологический
массаж: массирование ладоней и ступней воздействует на энергетические каналы,
пролегающие, по убеждениям некоторых ученых, от макушки до пяток. В некоторых
случаях оказывается полезным.
НПВП
Общие представления о НПВП
Все "традиционные" НПВП
имеют ряд общих химических и фармакологических свойств. Будучи слабыми
органическими кислотами, они хорошо абсорбируются в желудочно-кишечном тракте
(ЖКТ), сильно связываются с альбумином и имеют примерно одинаковый объем
распределения. Гипоальбуминемия ведет к увеличению сывороточной концентрации
"свободного" препарата и может обусловливать увеличение токсичности.
Продолжительность полужизни НПВП варьируется в широких пределах. Условно НПВП
подразделяются на короткоживущие (< 6 часов) и длительноживущие (> 6
часов). Терапевтический ответ и развитие токсических реакций зависят от многих
факторов, в том числе от времени, необходимого для достижения равновесного
состояния препарата в плазме, и приблизительно соответствуют 3-5-кратному
значению продолжительности полужизни. Следует подчеркнуть, что четкая связь
между периодом полужизни НПВП в плазме и его клинической эффективностью не
прослеживается. Это связано с тем, что "короткоживущие" препараты
длительно и в высокой концентрации сохраняются в зоне воспаления, например в полости
сустава. Поэтому двукратный прием "короткоживующих" препаратов
нередко столь же эффективен, как многократный.
Наиболее важный механизм,
определяющий как эффективность, так и токсичность НПВП, связан с подавлением
активности циклооксигеназы (ЦОГ) - фермента, регулирующего биотрансформацию
арахидоновой кислоты в простагландины (ПГ), простациклин и тромбоксан.
Особенно большое значение имеет
характер влияния НПВП на недавно открытые изоформы ЦОГ, которые обозначаются
как ЦОГ-1 и ЦОГ-2.
Первая (ЦОГ-1) постоянно присутствует в большинстве тканей (хотя и в различном
количестве), относится к категории "конститутивных"
("структурных") ферментов, регулирующих физиологические эффекты ПГ.
Напротив, ЦОГ-2 в норме в большинстве тканей не обнаруживается, но ее уровень
существенно увеличивается на фоне развития воспаления. Тем не менее, в
некоторых тканях (мозг, почки, кости и, вероятно, в репродуктивной системе у
женщин) ЦОГ-2 играет роль "структурного" фермента. К характерным
особенностям ЦОГ-2 следует отнести то, что ее экспрессия, в отличие от ЦОГ-1,
подавляется глюкокортикоидами. Ингибиция ЦОГ-2 рассматривается, как один из
важных механизмов противовоспалительной активности НПВП, а ЦОГ-1 - развития
побочных эффектов.
ЦОГ-1:
Конститутивная
Гомеостатическая
Патологическая
ЦОГ-2:
Регулируемая
Патологическая
Репарация тканей
Физиологическая
Поэтому эффективность и токсичность
"стандартных" НПВП связывают с их низкой селективностью, то есть
способностью в одинаковой степени подавлять активность обоих изоформ ЦОГ. Все
эти данные послужили основой для создания новой группы НПВП, которые обладают
всеми положительными свойствами "стандартных" НПВП, но менее
токсичны. Их определяют, как специфические ингибиторы ЦОГ-2 или ЦОГ-1
сберегающие препараты.
Таблица 1. Препараты по степени селективности ингибирования ЦОГ
|
Степень селективности к ЦОГ-1 или ЦОГ-2 |
Название препарата |
|
Выраженная селективность в отношении ЦОГ-1 |
Ацетилсалициловая кислота, Индометацин, Кетопрофен,
Пироксикам, Сулиндак |
|
Умеренная селективность в отношении ЦОГ-1 |
Диклофенак, Ибупрофен, Напроксен и др. |
|
Примерно равноценное ингибирование ЦОГ-1 и ЦОГ-2 |
Лорноксикам (Ксифокам) |
|
Умеренная селективность в отношении ЦОГ-2 |
Этодолак, Мелоксикам, Нимесулид, Набуметон |
|
Выраженная селективность в отношении ЦОГ-2 |
Целекоксиб, Рофекоксиб |
В настоящее время выделен еще 1
изофермен ЦОГ-3. Применив метод молекулярного клонирования, ученые обнаружили его
в ткани головного и спинного мозга собак, и доказали, что парацетамол подавляет
его активность, проявляя низкое сродство к ЦОГ-1 и ЦОГ-2
(Chandrasekharan N. et al., Proceeding of Academy of Sciences
2002.10.1073/pnas.162468699).
Американские ученые считают, что
обезболивающее и жаропонижающее действие парацетамола, механизм которого в
течениие более столетия оставался загадкой, связано именно с ингибицией ЦОГ-3.
В статье подчеркивается необходимость дальнейших исследований, направленных
прежде всего на выделение указанного фермента у человека. Но в целом данное
открытие — это заявка на возможность прорыва в современной науке о боли и
воспалении.
Клиническое применение НПВП
Несмотря на многолетнюю историю
применения и интенсивные исследования, все еще остается ряд нерешенных проблем,
касающихся оптимального лечения НПВП. Тем не менее клинический опыт (часто
эмпирический) позволил сформулировать некоторые общие принципы рационального применения
этих препаратов, направленных на повышение эффективности и снижение частоты
побочных эффектов.
Учитывая быстрое достижение
равновесного связывания с альбумином, уровень НПВП в кровяном русле в меньшей
степени влияет на эффективность, чем на токсичность. Поэтому увеличение
дозы "стандартных" НПВП больше рекомендуемой приводит к нарастанию
токсичности, но не эффективности лечения. Это касается и
преимущественных ингибиторов ЦОГ-2 (мелоксикам, нимесулид), прием которых в
высоких дозах ведет к потере селективности в отношении ингибиции ЦОГ-2.
По данным контролируемых
исследований любой "стандартный" НПВП по эффективности достоверно
превосходит плацебо и, по крайней мере, не уступает ацетилсалициловой кислоте в
высоких дозах. Уменьшение выраженности боли и признаков воспаления по
стандартизованным критериям отмечается примерно у 60-70% пациентов ОА и РА.
Однако поскольку "индивидуальный" ответ на НПВП у каждого
пациента может колебаться в широких пределах, нередко необходим подбор наиболее
эффективного препарата. Для достоверного вывода об эффективности или
отсутствии таковой препарат следует принимать не менее 2-4 недель в оптимальной
терапевтической дозе. Хотя этот подход пока не оценивался в специальных
проспективных контролируемых исследованиях, полагают, что при индивидуальном
подборе число пациентов, "отвечающих" на НПВП, может увеличиться до
90%.
Эмпирический подход к
индивидуальному подбору эффективного НПВП неприемлем в отношении поиска
наиболее безопасного препарата. К побочным эффектам относятся поражение
ЖКТ, нарушения агрегации тромбоцитов, функции почек, негативное влияние на
систему кровообращения. Другие побочные эффекты встречаются значительно
реже и, вероятно, не связаны с ин гибицией синтеза ПГ. Следует особо
подчеркнуть, что риск почти всех побочных эффектов более высок у лиц
пожилого и старческого, чем молодого возраста.
Факторы риска НПВП-индуцированных
поражений ЖКТ:
Факторы риска почечных и
сердечно-сосудистых побочных эффектов НПВП:
Общие принципы лечения НПВП хорошо известны. При выборе НПВП
следует принимать во внимание:
В процессе лечения необходим
тщательный клинический и лабораторный мониторинг побочных эффектов:
Базовое исследование –
Общий анализ крови, креатинин,
аспартатаминотрансфераза, аланинаминотрансфераза.
При наличии факторов риска –
обследование на наличие инфекции H.pylori, гастроскопия.
Клиническое обследование –
«Черный» стул, диспепсия,
тошнота/рвота, боли в животе, отеки, затруднение дыхания.
Лабораторное обследование –
Общий анализ крови 1 раз в год.
Печеночные пробы, креатинин (по мере необходимости).
Примечание: при лечении диклофенаком
аспартатаминотрансферазу и аланинаминотрансферазу следует определять через 8
нед. после начала лечения. При совмещенном приеме ингибиторов ангиотензинпревращающего
фермента (АПФ) сывороточный креатинин необходимо определять каждые 3 нед.
Лечение следует начинать с наименее
«токсичных» НПВП (диклофенак, ацеклофенак, кетопрофен, и особенно ибупрофен
<1200 мг/сут). Поскольку побочные эффекты НПВП имеют зависимый от дозы
характер, необходимо стремиться к назначению минимальной, но эффективной дозы.
Частота случаев побочных реакций на фоне НПВП у пациентов старше 65 лет
представлена в таблице 2.
Ксефокам.
Патентованное название: Лорноксикам
Фармакологические свойства. Нестероидное противовоспалительное
средство класса оксикамов.
Фармакодинамика. Оказывает выраженное анальгетическое
и противовоспалительное действие. Лорноксикам обладает сложным механизмом действия, в основе
которого лежит сбалансированное подавление синтеза простагландинов и фермента
циклооксигеназы-2. Кроме того, лорноксикам угнетает высвобождение свободных
радикалов кислорода из активированных лейкоцитов.
Анальгетический эффект лорноксикама
не связан с наркотическим действием. Препарат Ксефокам не оказывает
опиатоподобного действия на ЦНС и, поэтому, не угнетает дыхание, не вызывает
миотический эффект и, в отличие от наркотических анальгетиков, не вызывает
лекарственной зависимости.
Фармакокинетика. Лорноксикам быстро и практически
полностью всасывается из ЖКТ после приема внутрь. При этом максимальные
концентрации в плазме достигаются примерно через 1-2 ч.
Абсолютная биодоступность
лорноксикама составляет 90-100%.
Лорноксикам присутствует в плазме, в
основном, в неизменном виде и, в меньшей степени, в форме гидроксилированного
метаболита, который не обладает фармакологической активностью.
Связывание лорноксикама с белками
плазмы, преимущественно с альбуминовой фракцией, составляет 99% и не зависит от
его концентрации.
Период полувыведения, в среднем,
составляет 4 ч и не зависит от концентрации препарата.
Лорноксикам полностью
метаболизируется. Примерно 1/3 метаболитов выводится из организма почками и 2/3
- печенью.
У лиц пожилого возраста, а также у
пациентов с почечной или печёночной недостаточностью не обнаружено значимых
изменений фармакокинетики лорноксикама.
- умеренный и выраженный болевой
синдром;
- симптоматическое лечение боли и
воспаления при воспалительных и дегенеративных ревматических заболеваниях..
Противопоказания
- гиперчувствительность к
лорноксикаму, ацетилсилициловой кислоте или другим нестероидным
противовоспалительным средствам;
- острое желудочно-кишечное
кровотечение;
- обострение язвенной болезни
желудка и двенадцатиперстной кишки;
- гематологические нарушения неясной
этиологии;
- беременность и грудное
вскармливание;
- возраст до18 лет.
Для приема внутрь при умеренном и выраженном
болевом синдроме вначале принимают ударную дозу 16 мг, далее, при
необходимости, дозу увеличивают с шагом 8 мг, доводя максимальную дозу в первые
24 ч до 32 мг. В дальнейшем назначают по 8 мг 2 раза в сутки, максимальная
суточная доза -16 мг.
При воспалительных и
дегенеративных ревматических заболеваниях дозу устанавливают индивидуально.
Стандартная доза составляет 8-16 мг в сутки, в зависимости от состояния
пациента. Рекомендуются следующие схемы терапии:
Суточная доза Схема приема
16 мг по одной таблетке Ксефокам 8
мг 2 раза в сутки
12 мг по одной таблетке Ксефокам 4
мг 3 раза в сутки
8 мг по одной таблетке Ксефокам 4 мг
2 раза в сутки
При длительной терапии суточная доза
не должна превышать 16 мг.
Таблетки Ксефокама принимают внутрь
перед едой, запивая стаканом воды.
При заболеваниях ЖКТ, больным с
нарушениями функции почек или печени, лицам пожилого возраста (старше 65 лет),
пациентам с массой тела менее 50 кг, а также после перенесенного обширного
оперативного вмешательства Ксефокам назначают в дозе 8 мг в сутки (по одной
таблетке Ксефокама 4 мг 2 раза в сутки).
Особые
указания. С осторожностью
Ксефокам можно принимать при следующих заболеваниях:
Перед применением Ксефокама при
данных заболеваниях необходимо проконсультироваться с врачом.
Со стороны ЖКТ и печени: боли в животе, диарея, диспепсия,
тошнота, рвота; в редких случаях - метеоризм, сухость во рту, гастрит,
эзофагит, образование пептических язв и/ил кровотечения в ЖКТ (в т.ч.,
ректальные кровотечения), нарушения функции печени.
Аллергические реакции: возможны кожные высыпания, реакции
повышенной чувствительности, сопровождающиеся одышкой, тахикардией.
Со стороны ЦНС: редко - головокружение, головная
боль,сонливость, состояние возбуждения, нарушения сна.
Ксефокам обладает типичными для всех
НПВП видами побочного действия
Необходимо соблюдать повышенную
осторожность при управлении автомобилем или работе с другими движущимися
механизмами, поскольку препарат Ксефокам увеличивает время реакции.
Симптомы: возможно усиление описанных
побочных эффектов Ксефокама.
Лечение: симптоматическое.
Прием активированного угля сразу
после приема Ксефокама может способствовать снижению всасывания этого
препарата. Для устранения желудочно-кишечных нарушений, вызванных препаратом
Ксефокам, можно использовать аналог простагландина или ранитидин.
Форма выпуска. Таблетки по 4 мг и 8 мг , по 10
табл. в упаковке.
Перед применением обязательно
ознакомтесь с инструкцией по применению препарата Ксефокам.
Препарат отпускается по рецепту
врача.
Производитель: НИКОМЕД Австрия Гмбх, Австрия
Метамизол (Анальгин, дипирон)
В
клиническую практику метамизол был впервые внедрен в Германии в 1922 г. Но в
отличие от многих стран мира в Росcии метамизол и метамизолсодержащие препараты
вплоть до сих пор являются наиболее широко используемыми анальгетиками.
Российский «амбулаторный»
фармацевтический сектор 1998-1999 гг., представлен большим числом отечественных
и зарубежных моно- и поликомпонентных неопиоидных анальгетиков среди которых
метамизол-содержащие препараты занимают заметное место. Среди
метамизол-содержащих комбинированных анальгетиков наиболее популярны на
российском рынке Баралгин, Беллалгин, Беналгин, Максиган, Пиренал, Спазган,
Темпалгин.
Моно- и поликомпонентные анальгетики
широко используются в практике врачебных назначений и самолечения, что
подтверждается данными опросов посетителей аптек и врачей амбулаторного звена.
Посетители аптек при необходимости снятия боли почти в половине случаев
предпочитают покупать препараты метамизола, врачи назначают метамизол в 7%,
метамизол-содержащие препараты - в 25%.
Метамизол используется в России
более 30 лет. Несмотря или благодаря множеству противоречивых инструкций,
метамизол и его продукты для перорального приема являются практически
безрецептурными и реализуется во всех аптечных пунктах и стационарных аптечных
учреждениях.
Устойчивая популярность метамизола,
вероятно, связана не только с неизменностью государственной фармакопеи и
консерватизмом программ обучения, но и с отсутствием полноценной информации для
больных.
Официальные комментарии ВОЗ по
метамизолу выглядят так:
«Метамизол натрия, производное
пиразолонового ряда с анальгетической, антипиретической и противовоспалительной
активностью, был представлен на рынке в 1921 г. и с тех пор широко используется
как по врачебным показаниям, так и как безрецептурное ЛС. Однако с начала 70-х
годов, с развитием системы контроля побочных реакций, появились сведения о
серьезных побочных реакциях, ассоциированных с приемом метамизола (как и
некоторых других производных пиразолонового ряда). Эти реакции, в некоторых
случаях со смертельным исходом, выражались, прежде всего, в развитии
агранулоцитоза.
Сейчас рынок метамизол-содержащих
средств ограничен узким кругом развивающихся стран. В 1978 г. компания Hoechst
AG, основной производитель метамизола, объявила об организации международного
независимого эпидемиологического исследования по агранулоцитозу и апластической
анемии (International Agranulocytosis and Aplastic Anemia Study - IAAAS) для
выяснения степени риска данных побочных реакций у принимающих
метамизолсодержащие препараты. Были проанализированы сведения об использовании
препарата 22,2 млн. больных и случаях агранулоцитоза среди них, приведших к
госпитализации. Относительный риск агранулоцитоза составил 0,6-1 на 1 млн. человек
в неделю. Другими словами, если один миллион человек принимает препарат один
или несколько раз в неделю, то можно ожидать, что у одного из них может
развиться агранулоцитоз. Однако, по мнению отдельных специалистов, этот вывод
некорректен. «Данные о риске 1:1 000 000 связываются с приемом препарата в
течение недели, в то время как частоту агранулоцитоза принято рассчитывать
исходя из случаев, зарегистрированных в течение 1 года. Исходя из данных
предпосылок, можно легко определить истинное положение дел. С учетом этой
поправки риск составит 1 случай агранулоцитоза на каждые 20 000 принимающих
метамизол в год».
Реальный риск от применения
метамизола приблизительно в 50 раз выше, чем это было продемонстрировано
исследованием (IAAAS) и пропагандируется производителями.
В Нидерландах, где система
фармакобдительности является во многом эталонной для многих стран, с 1974 по
1990 годы из 425 случаев зарегистрированного там лекарственного агранулоцитоза,
метамизол был наиболее частой его причиной, причем, в большей части случаев
менее чем за десять дней приема препарата.
На рынке Швеции метамизол
присутствовал с 1934 по 1974 годы, затем был выведен из обращения в связи с
регистрацией большого числа лекарственных агранулоцитозов. В 1995 г. метамизол
там был вновь зарегистрирован, но уже по более узким показаниям: «краткосрочное
применение в случаях острой, умеренной или выраженной боли, вторичной по
отношению к повреждению тканей - после хирургичеcких вмешательств, при почечной
или печеночной колике».
Основным мотивом к повторной
регистрации было появление данных масштабного эпидемиологического исследования,
продемонстрировавшего не столь значительный риск агранулоцитоза. Однако с
момента повторной регистрации в 1996 г. в Швеции вновь стали регистрироваться
случаи агранулоцитоза. Продажи метамизола в Швеции были вновь остановлены с 28
апреля 1999 г. Все складские запасы, остатки препарата в аптечной сети были
полностью ликвидированы.
В Германии, откуда метамизол вышел
на международный рынок, с 1987 г. большинство препаратов, в состав которых
входил метамизол, были запрещены. Неоднозначность результатов исследования
IAAAS заставили Управление здравоохранения Германии (BGA) в марте 1987 г.
принять решение о значительном ограничении использования метамизола как моносубстанции
в соответствии со следующими показаниями: терапия сильной острой боли в
послеоперационном периоде, острая колика, боли при онкологических процессах, а
также другие острые болевые синдромы не поддающиеся иной терапии.
А в 1990 г. были отозваны все
лицензии на метамизол-содержащие комбинированные препараты. Главной причиной
для этого шага было отсутствие определенности в сведениях о побочных эффектах
метамизола.
Был проведен поиск публикаций,
касающихся проблемы метамизола по международной базе литературных данных
MEDLINE с использованием ключевых слов «metamizole» или «dipyrone» за период с
1960 по 1999 гг. В результате были получены данные о 398 статьях. Публикации о
побочных реакциях метамизола составляют примерно 24% от известных литературных
данных (94 из 398) и большинство из них - об агранулоцитозе. В последние годы
большое внимание стало уделяться также канцерогенности, гепато- и нефро-
токсичности метамизола. В публикациях, с одной стороны, прослеживается
направленная дискредитация метамизола, а с другой, - стимуляция
исследовательской активности по расширению показаний к использованию
метамизола, выяснению его новой роли, например, в качестве антиконвульсанта,
спазмолитического анальгетика или просто конкуретноспособного анальгетика. Вплоть
до переориентации на рынок ветеринарных препаратов.
Начиная с 1990 г. в информации о
метамизоле соотношение между положительными (новые данные об эффективности,
сравнительные исследования, новое позиционирование и т.п.) и отрицательными
сведениями стало меняться. Если в 80- х оно составляло 143:50, то в 90-х уже
173:29. По всей видимости, это связано с постепенным вытеснением метамизола с
рынка стран с развитой и действующей системой контроля за переносимостью и
побочными реакциями на рынки менее щепетильных и более бедных государств.
Безопасность аналгетиков, как и
многих других лекарственных средств, определяется также особенностями
метаболизма. Парацетамол
метаболизи-руется в печени тремя путями: конъюгацией с глюкуронидами (60%),
сульфатированием (35%) и биотрансформацией в системе ферментов цитохрома Р-450
(5%) (В.Т. Ивашкин и со-авт., 1999). Последний путь приводит к образованию
пара-цетамоловых конъюгатов - производных цистеина и меркапту-ровой кислоты.
Они обладают гепато- и нефротоксичностью, что может представлять опасность,
особенно у детей (А.М. Запруднов, 1994). Вместе с тем, токсические эффекты
парацетамола возникают, как правило, если он применяется в больших дозах, в
среднетерапевти-ческих (если только он не применяется одновременно с такими
активаторами системы цитохрома Р-450, как барбитура-ты, зиксорин, рифампицин,
тео-филлин) дозировках он практически не токсичен.
Виды и этапы обезболивания.
Виды обезболивания:
1.
Местная
анестезия:
- терминальная (поверхностная)
- инфильтрационная анестезия
- проводниковая (регионарная)
анестезия
- эпидуральная анестезия
- спинальная (субарахноидальная)
анестезия
2.
Неингаляционная общая анестезия (наркоз)
3.
Ингаляционная общая анестезия
Этапы обезболивания
1.
Премедикация:
2.
Наркоз
Задачи премедикации:
1)
предотвращение
предоперационного операционного стресса;
2)
достижение
нейровегетативной стабилизации;
3)
снижение
реакции на внешние раздражители;
4)
уменьшение
секреции желез;
5)
создание
оптимальных условий для проявления действия общих анестетиков
6)
профилактика аллергических реакций в ответ на
применение в процессе анестезии медикаментов и инфузионных сред.
Для премедикации в анестезиологии
применяют несколько групп фармакологических средств: снотворные (барбитураты,
бензодиазепины), психотропные средства (транквилизаторы бензодиазепинового
рядя, нейролептики фенотиазинового и бутирофенонового ряда), наркотические
анальгетики, холиноблокирующие и антигистаминные средства.